Ley de Boyle: Relación Volumen- Presión
Robert Boyle realizo un
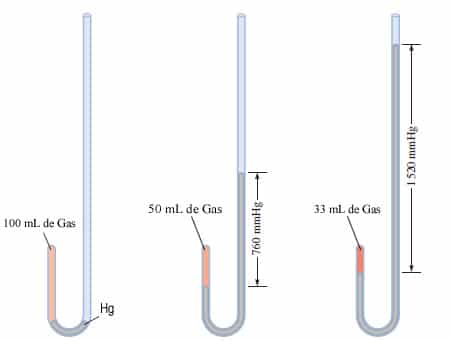
experimento, una muestra de gas atrapada en un tubo en U que contenía mercurio
y que se deja hasta que la temperatura sea contante, se registran el volumen y
la diferencia de alturas de las dos columnas de mercurio; esta diferencia de
alturas más la presión de la atmosfera representan la presión del gas. Entre más
mercurio más presión aumentando la altura de la columna y menos volumen del
gas.
| Robert Boyle. |
Experimento de Boyle
que demuestra la relación de la presión y el volumen a una temperatura dada.
Demostró entonces que: A una
temperatura, el producto de la presión y el volumen de una masa de gas es
constante.
PV=K (T, n constantes)
Ley de Boyle: El valor
de K depende de la cantidad (moles n) de gas y de la temperatura. Cuando el
volumen se traza en función.
Cuando se traza una gráfica
del volumen de un gas en función de la presión a temperatura constante la curva que se genera es
una media hipérbola.
A temperatura constante
el volumen V, que ocupa una masa definida de gas es inversamente proporcional a
la presión
aplicada
A temperatura y presión
normales, casi todos los gases siguen la ley de Boyle. A esto se le llama
comportamiento ideal
Considérese una masa fija de gas a temperatura constante
pero en dos condiciones diferentes de presión y volumen.
1ra condicion: P1V1= k
(T, n constantes)
2da condicion: P2V2= k
(T, n constantes)
Puesto que los miembros
de la derecha de estas dos ecuaciones son iguales los miembros del lado
izquierdo deben ser iguales
P1V1= P2V2 (Para una cantidad de gas a
temperatura constante)
Esta forma de la ley de
Boyle es útil en
cálculos que comprenden
cambios de presión y
volumen.
volumen.
Ley de Charles: Relación Volumen-Temperatura, Escala de Temperatura Absoluta
En sus estudios de presión-volumen en gases, Robert Boyle advirtió que el calentamiento de
una muestra de gas causaba un cambio de volumen. En 1880 dos científicos
franceses Jacques Charles y Joseph Gay-Lussac pioneros en globos aerostáticos
en ese tiempo, comenzaron a estudiar a expansión de los gases con el incremento
de temperatura. Con sus estudios demostraron que la rapidez de expansión de un
gas, con el aumento de su temperatura, era constante y que era igual para todos
los gases que estudiaron, ya que la presión era constante. Los científicos
utilizaron este comportamiento de los gases como fundamento de una nueva escala
e temperatura, la de la temperatura absoluta.
Jacques Charles
Lord Kelvin, físico ingles, advirtió que la extrapolación de
las líneas temperatura-volumen a volumen cero (línea punteada) se intersectaba
en un punto común a -273.15 °C sobre el eje de la
temperatura. Kelvin le dio el nombre de cero absoluto a esta. Los grados son de
misma magnitud en todas las escalas, de modo que 0 °C se convierten en 273.15
grados sobre el cero absoluto. En reconociemto se le dio el nombre a la escala
de temperatura Kelvin. La relación entre la temperatura Celsius y Kelvin es:
K= °C + 273.15
Si se convierten
temperaturas (°C) en temperaturas absolutas (°K), la relación
volumen-temperatura se vuelve obvia, a esta relacion se le da el nombre de Ley
de Charles.
Podemos expresar la Ley de
Charles se puede expresar de la siguiente manera
V= kT ( P, n constantes)
Reordenando la expresión
se obtiene V/T= k un enunciado conciso de la Ley de Charles que a medida que
aumenta la temperatura, el volumen aumenta en forma proporcional
V/T1 = V/T2
Que resulta ser la forma más
útil de la Ley de Charles. Esta relación solo es válida cuando la temperatura, T,
se expresa en términos de la escala absoluta (de ordinario la Kelvin)
Ley de Gay-Lussac de Volúmenes que se combinan y Ley de Avogadro
Joseph
Gay- Lussac, químico francés, estudio los volúmenes de los gases que reaccionan
y se forman en las reacciones químicas. En 1808 publico sus resultados: para
reacciones que se llevan a cabo a temperatura y presión constantes, los volúmenes
de los gases implicados son reacciones de números enteros pequeños.
Ley de Gay-Lussac de los
volúmenes que se combinan:
A temperatura y presión
constante, los volúmenes de los gases que intervienen en reacciones químicas
forman relaciones iguales a números enteros pequeños.
Para
explicar por qué sucede lo anterior, Amedeo Avogadro, físico italiano, sugirió
en 1811 que volúmenes iguales de todos los gases a la misma temperatura y
presión contienen el mismo número de moléculas.
En
otras palabras, 100 moléculas de cualquier gas tienen el mismo volumen. Las
densidades de los líquidos y los sólidos son del orden de gramos por centímetro
cubico, mientras que las de los gases son del orden de 0.001 gramo por
centímetro cubico. Si imaginamos que los gases son en su mayor parte espacio
vacío, donde las moléculas solo ocupan una pequeña parte del volumen total del
gas, esto explicara las bajas densidades de los gases, porque volúmenes iguales
de todos los gases a la misma temperatura y presión contienen la misma cantidad
de moléculas
.
Un gas formado por
moléculas pequeñas que se mueven con rapidez en un volumen grande, se llama teoría
cinético-molecular.
Relación entre la presión y la temperatura de un gas cuando el volumen es constante
Fue
enunciada por Joseph Louis Gay-Lussac a principios de 1800. Establece
la relación entre la temperatura y la presión de un gas cuando el volumen es
constante.
La presión del gas es
directamente proporcional a su temperatura:
- · Si aumentamos la temperatura, aumentará la presión.
- · Si disminuimos la temperatura, disminuirá la presión.
¿Por qué ocurre esto?
Al
aumentar la temperatura las moléculas del gas se mueven más rápidamente y por
tanto aumenta el número de choques contra las paredes, es decir aumenta la
presión ya que el recipiente es de paredes fijas y su volumen no puede cambiar.
Gay-Lussac
descubrió que, en cualquier momento de este proceso, el cociente entre la
presión y la temperatura siempre tenía el mismo valor:
PT=kPT=k
(El
cociente entre la presión y la temperatura es constante)
Supongamos que tenemos un gas que se encuentra
a una presión P1 y a
una temperatura T1 al
comienzo del experimento. Si variamos la temperatura hasta un nuevo valor T2,
entonces la presión cambiará a P2, y se cumplirá:
P1T1=P2T2
Que
es otra manera de expresar la ley de Gay-Lussac.
Esta
ley, al igual que la de Charles, está expresada en función de la temperatura
absoluta. Al igual que en la ley de Charles, las temperaturas han de expresarse
en Kelvin.



Muy buena organización y simplificada. Con buenos ejemplos que la ilustran.
ResponderEliminarY un excelente diseño. Que proporciona una mejor presentación.